AutorIn
Heinz Stutzenberger, Alpha1 Deutschland e.V., so erschienen im Alpha1-Journal 1/2022.
Unter der Rubrik „Forschung & Studien“ unseres Internetauftrittes finden Sie meist mehrere Aufrufe zur Teilnahme an wissenschaftlichen Studien. Dabei handelt es sich üblicherweise um die dritte und letzte Studienphase im Rahmen eines standardisierten Verfahrens zur Zulassung von neuen Medikamenten (eine vierte Stufe nach der Zulassung ist ebenfalls möglich, s. u.). In dieser Phase 3 werden Unbedenklichkeit und Wirksamkeit neuer Arzneimittel nachgewiesen. Sie baut auf Studien in früheren Phasen auf, und eine Phase-3-Studie wird nur dann eingeleitet, wenn die Ergebnisse der vorangegangenen Studienphasen positiv sind.
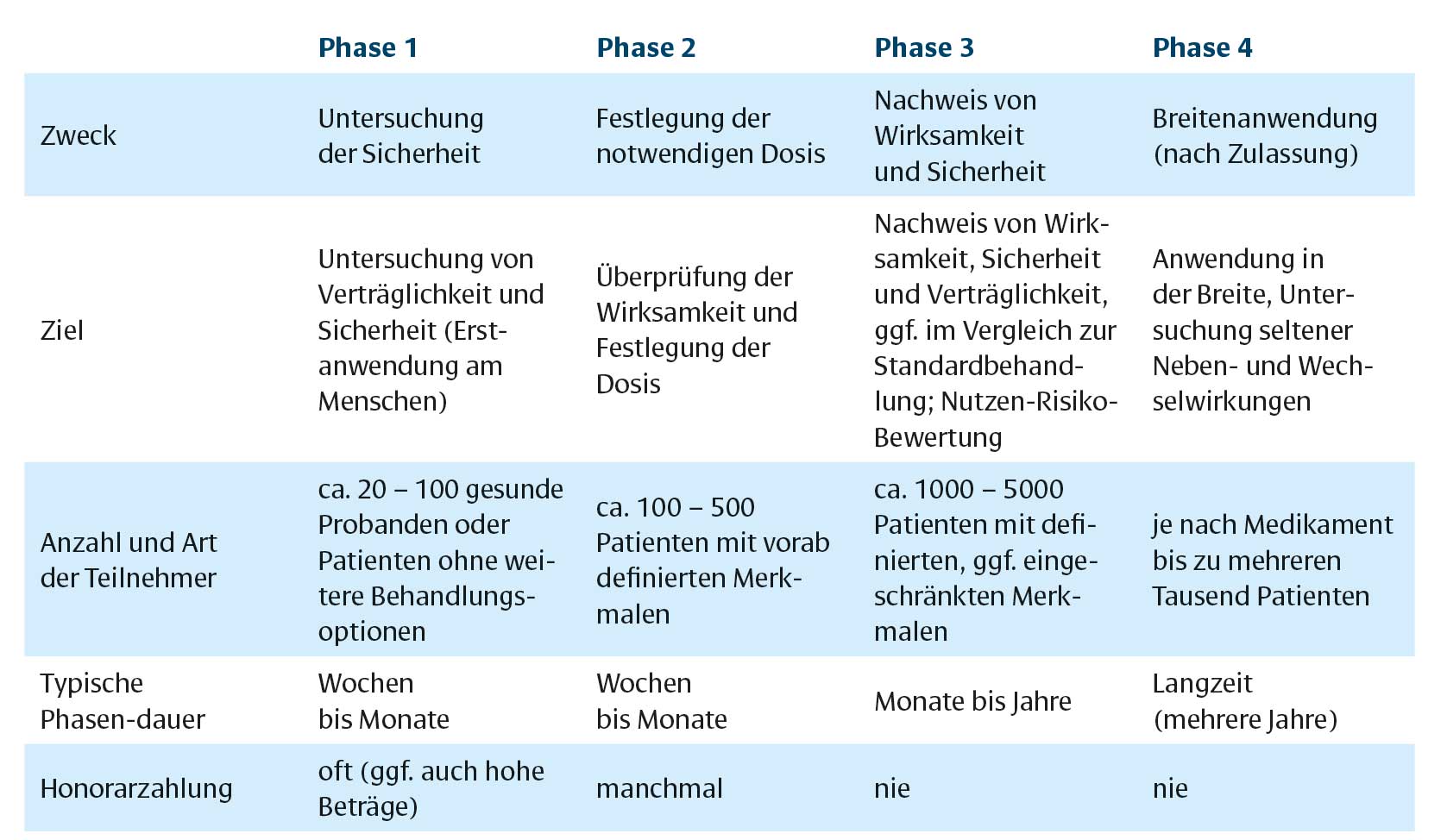
Die Inhalte der einzelnen Studienphasen stellen sich wie folgt dar1,2:
Phase 1: Untersuchung von Verträglichkeit und Sicherheit
- erstmalige Anwendung des Medikamentes am Menschen, um Verträglichkeit, Sicherheit und Verhalten des Wirkstoffs im Körper zu untersuchen
- typischerweise bis zu 100 Studienteilnehmer, die entweder gesund sind oder für die es keine andere Therapieoption (mehr) gibt
- diese Phase dauert Wochen bis Monate
- wegen des mit der Erstanwendung am Menschen verbundenen Risikos werden den Teilnehmern oft beträchtliche Honorare gezahlt
Phase 2: Überprüfung der Wirksamkeit, Ermittlung sinnvoller Dosierungen
- bei einer streng definierten Gruppe von bis zu 500 Patienten wird geprüft, ob und in welcher Dosierung das Präparat für die Behandlung der Erkrankung wirksam ist
- auch diese Phase dauert Wochen bis Monate
- üblicherweise werden für die Teilnahme an dieser Phase keine Honorare gezahlt
Phase 3: Belegung von Wirksamkeit und Sicherheit
- Untersuchung von Wirksamkeit und Verträglichkeit des Präparates und die Bewertung seines Nutzens, auch im Hinblick auf Häufigkeit und Schwere von Nebenwirkungen
- eine größere Teilnehmergruppe von oft über 1.000 Patienten ermöglicht es, auch weniger häufige Nebenwirkungen besser einzuschätzen
- diese Phase dauert Monate bis Jahre
- sie wird oft als randomisierte Doppelblind-Studie durchgeführt, bei der
- die Teilnehmer nach dem Zufallsprinzip in zwei Gruppen eingeteilt werden
- nur eine Gruppe das Medikament erhält, wohingegen die andere ein Placebo erhält
- weder die Studienteilnehmer noch die Studienhelfer (die teilnehmenden Ärzte) wissen, wer Medikament oder Placebo bekommt
- die Teilnehmer erhalten kein Honorar, es soll keinerlei finanzielle Anreize für die Teilnahme geben
- nach Ende dieser Phase sehen die Folgeschritte so aus:
- eine intensive Auswertung der vorliegenden und weiteren Studienergebnissen
- die Begutachtung der Ergebnisse durch weitere Fachgremien
- und schließlich der Antrag auf Zulassung des neuen Arzneimittels bei der zuständigen Behörde
- diese Phase-3-Studien sind die für AATM-Betroffene interessanten
Phase 4: Langzeitbeobachtung zum Erkennen von Nebenwirkungen
- erfolgt erst nach der Zulassung an einer großen Zahl von Patienten (oft über 1.000)
- dient dem Erkennen seltener Nebenwirkungen oder auch Wechselwirkungen mit anderen Medikamenten
- betrachtet gegebenenfalls auch bestimmten Patientengruppen, z. B. eine bestimmte Altersgruppe, Personen mit bestimmten Krankheitsbildern und ähnlichem
Die wichtigsten Punkte der einzelnen Studienphasen sind nochmals in der untenstehenden Tabelle zusammengefasst:
Wie bereits erwähnt, sind für AATM-Betroffene Phase3-Studien interessant, meist durchgeführt als randomisierte Doppelblind-Studie. Wer sich für die Teilnahme an einer Studie ernsthaft interessiert, wird in einem ersten Schritt die „Patienteninformation und Einverständniserklärung“ mit dem betreuenden Arzt durchgehen. Damit wird sichergestellt, dass1
- der potenzielle Teilnehmer die klinische Studie einschließlich aller Abläufe, möglicher Nebenwirkungen und anderer Risiken, die mit der Teilnahme an der Studie oder deren Ablauf verbunden sein können, vollständig versteht
- er sich seiner Verantwortung als Teilnehmerin bzw. Teilnehmer an der klinischen Studie bewusst ist
- alle seine Fragen in Bezug auf die klinische Studie beantwortet werden
- er weiß, dass er die klinische Studie jederzeit ohne Angabe von Gründen verlassen kann
Relevante Fragen, die dabei geklärt werden sollten, sind1:
- Was ist das konkrete Ziel der klinischen Studie?
- Wie ist der Ablauf der Studie geplant?
- Welche studienbegleitenden Untersuchungen sind vorgesehen?
- Wer finanziert die Studie?
- Entstehen dem Teilnehmer durch die Studienteilnahme Kosten?
- Gibt es eine Aufwandsentschädigung?
- Ist eine Probandenversicherung abgeschlossen worden?
- Mit welchem zeitlichen Aufwand ist die Teilnahme verbunden?
- Welche Verpflichtungen sind mit der Studienteilnahme verbunden?
- Ist eine längere Nachbeobachtung nach Abschluss der Studie erforderlich?
- Welchen Nutzen und welche Risiken birgt die Studienteilnahme im Vergleich zu bisherigen Therapieverfahren?
- Welche Erfahrungen liegen für das neue Therapieverfahren bereits vor?
- Mit welchen Nebenwirkungen ist zu rechnen?
- Wer ist für die Studienbetreuung verantwortlich?
- Wer kann im Notfall oder bei auftretenden Fragen kontaktiert werden?
- Welche Daten werden erhoben, verarbeitet und gespeichert?
- Mit welchen Einschränkungen muss zu Beginn oder während der klinischen Studie gerechnet werden (z. B. keine Schwangerschaft, kein Alkohol)?
- Was passiert, wenn die Studie vorzeitig beendet wird?
- Falls erforderlich: wie kann die Behandlung nach dem Studienende weitergeführt werden?
Teilnahme an klinischen Studien: Flexibilität und Verantwortung im Entscheidungsprozess
Beruhigend ist vor einer Entscheidung das Wissen, dass ein Teilnehmer jederzeit ohne Angaben von Gründen und ohne Inkaufnahme weiterer Nachteile die Studie verlassen kann. Dabei ist allerdings zu beachten, dass die Studien für das initiierende Pharmaunternehmen sehr hohe Kosten verursachen und das Ausscheiden von Teilnehmern die Aussagekraft der Studie reduzieren kann, sodass ein Ausscheiden nicht leichtfertig erfolgen sollte oder ein solches nicht bereits bei der Entscheidung zur Teilnahme fest einkalkuliert werden sollte. Üblicherweise fragen die Organisatoren im Falle eines Ausscheidens nach den Gründen und insbesondere danach, ob diese mit den (Neben-)Wirkungen des Medikamentes in Verbindung stehen; diese Fragen kann der ausscheidende Teilnehmer beantworten, er muss es aber nicht, s.o..
Auch sollten Teilnehmer sich bewusst sein, dass das durchführende Pharmaunternehmen zum Ziel hat, mit der Zulassung eines Medikamentes Umsatz und Gewinn zu generieren. Das erscheint aber als ein legitimer Ansatz, da nur so die Forschung an neuen Arzneimitteln sichergestellt werden kann, insbesondere auch an solchen für so seltene Krankheiten wie AATM. Staatliche Stellen betreiben keine Medikamentenentwicklungen (mehr), sondern leisten allenfalls Förderzuschüsse für Grundlagenforschung und die Studienphasen 1 und 2.3
Teilnahme an Phase-3-Studien: Chancen erkennen und Risiken im Blick behalten
Allerdings gibt auch dieser Aspekt wieder ein zusätzliches Maß an Sicherheit für die Studienteilnehmer, denn die Pharmaunternehmen treiben großen Aufwand, um Schadenersatzforderungen aus Entwicklung und Vertrieb ungeeigneter Medikamente zu vermeiden. Trotz des bei neuartigen Medikamenten unvermeidbaren Restrisikos bietet die Teilnahme an Phase-3-Studien aus unserer Sicht mehr Chancen als Risiken, und wir möchten Sie ermuntern, die Teilnahme an Studien, für die Sie infrage kommen, ernsthaft in Erwägung zu ziehen.
Sollte sich jemand nach reiflicher Überlegung zur Teilnahme an einer Phase-3-Doppelblind-Studie entschließen, insbesondere in der Hoffnung, endlich ein wirksames Medikament für die Beherrschung oder gegen das Fortschreiten seiner Krankheit zu bekommen, stehen seine Chancen auf eine verbesserte Heilbehandlung natürlich nur bei 50 %, da er ja mit genau dieser Wahrscheinlichkeit auch der Gruppe der Placebo-Empfänger zugelost werden kann.
Aber selbst dann erwachsen ihm aus der Teilnahme noch nennenswerte Vorteile, z. B.
- eine intensivierte Verfolgung seines Gesundheitszustandes und seines Krankheitsgeschehens durch die studienbegleitenden Untersuchungen
- das Bewusstsein, einen relevanten Beitrag geleistet zu haben für diejenigen Patienten, die nach der Zulassung in den Genuss der verbesserten Behandlung kommen
- möglicherweise auch noch eine Intensivierung der Selbstheilungskräfte des Körpers als Folge der bewussten Entscheidung, aktiv etwas für seine Gesundung zu unternehmen und dabei von fürsorglichen, empathischen Begleitern unterstützt zu werden4
Quellen
- janssenwithme.de, letzter Zugriff 24.01.2024.
- csl.com, letzter Zugriff 24.01.2024.
- bmbf.de, letzter Zugriff 24.01.2024.
- Mende, Annette: Scheinmedikament mit echter Wirkung, Pharmazeutische Zeitung, Ausgabe 51/52/2012.